18個氮原子組成的環狀分子長什么樣?一篇文章全面揭示18氮環的特征!
18個氮原子組成的環狀分子長什么樣?一篇文章全面揭示18氮環的特征!
What does a ring molecule composed of 18 nitrogen atoms look like? A paper fully reveals the characteristics of cyclo[18]nitrogen!
文/Sobereva@北京科音 2024-Aug-31
0 前言
2019年首次在凝聚相中發現的18個碳原子相連構成的環狀體系18碳環(cyclo[18]carbon)已經廣為知曉,筆者對此體系及衍生物陸續做過大量理論研究,成果匯總見http://www.shanxitv.org/carbon_ring.html。在研究18碳環的過程中有一個問題引發了筆者的好奇心:18個氮原子形成的18氮環(cyclo[18]nitrogen)會是什么結構?能否存在?具有什么性質?之前無論是實驗還是理論研究,都完全沒有18氮環或其它的較大的純氮環體系的報道。無疑通過量子化學計算和電子波函數分析回答這些問題非常有理論和實際意義。應ChemPhysChem期刊的邀請,筆者近期在此期刊上發表了18氮環的專題研究,歡迎閱讀和引用:
Tian Lu, Theoretical Prediction and Comprehensive Characterization of an all-Nitrogenatomic Ring, Cyclo[18]Nitrogen (N18), ChemPhysChem, 25, e202400377 (2024) DOI: 10.1002/cphc.202400377
此文可以在此免費在線閱讀:https://onlinelibrary.wiley.com/share/author/YPJDJ5XPMVT8SD7VDDYQ?target=10.1002/cphc.202400377
下面,筆者將對這篇文章的關鍵內容進行深入淺出的介紹,同時對研究思想和細節做一些補充說明,以幫助讀者更好、更容易地理解這篇文章的工作。此文的研究內容和手段對于理論探究其它特征新奇的物質也很有借鑒意義。
1 18氮環的構型
理論研究一個完全未知的物質,最先要研究的是它的幾何結構,然后再說其它的。有的體系有可能存在多個有意義的極小點構型,就都得優化出來并對比能量,以弄清楚哪個是熱力學上最穩定的、最需要關注的,以及不同構型的分布比例如何。ωB97XD/def2-TZVP是優化大部分體系很靠譜的級別,筆者之前做過的18碳環及各種衍生物的研究也都是用這個級別優化,因此對18氮環也首先用Gaussian 16在這個級別下做了優化,總共得到了以下結構,三個極小點分別對應C1、D3、D9點群。圖中為了令其結構特征看得盡可能清楚,給了俯視圖和側視圖,并且讓分子最大程度平行于XY平面,并在VMD里根據Z坐標按照色彩刻度條進行了著色。可見,18氮環的極小點結構并不是18碳環那樣嚴格純平面的,而是彎折的,這和18氮環具有孤對電子而缺乏全局離域的pi電子有關,詳見后文。
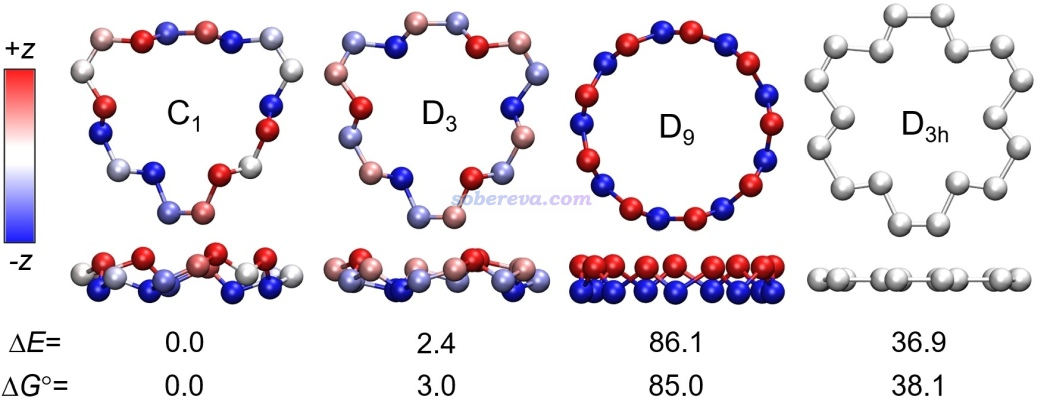
此文用ORCA在非常精確的DLPNO-CCSD(T1)/cc-pVQZ級別下對上述優化完的結構計算了電子能量,不同構型間相對電子能量如圖中的ΔE所示(kcal/mol)。文章還利用Shermo程序(http://www.shanxitv.org/552)計算了標況下的自由能熱校正量并與電子能量相加得到自由能,標況下的相對自由能如圖中ΔG所示(kcal/mol)。可見,能量關系是D9>>D3>C1。因此看似結構理想、對稱性特別高、像皇冠一樣的D9結構實際上無法在現實中出現。根據《根據Boltzmann分布計算分子不同構象所占比例》(http://www.shanxitv.org/165)介紹的方法,可以算出標況下D3的出現比率也可以忽略不計,C1和它出現比率是158:1。所以本文后面的研究基本都只基于C1結構來做。
為了確認是否有比上述C1能量更低的18氮環的結構,此文還借助molclus程序(http://www.keinsci.com/research/molclus.html)做了構型搜索。具體來說,此文在相對便宜的ωB97XD/def2-SVP級別下控溫在較高溫度跑了5 ps從頭算動力學模擬對勢能面進行采樣,每隔0.4 ps提取一幀用molclus做批量優化,最后發現所有結構都收斂到了C1,因此可以確信不存在能量更低的結構。注:實測ωB97XD/def2-SVP級別會嚴重高估18氮環的解離勢壘,所以用較高溫度跑動力學時也不至于出現解離。
可能有讀者想問上述三種極小點結構是怎么獲得的。由于18氮環實際長什么樣事先完全無法估計,筆者的做法是把18碳環里面每個碳都替換為氮,然后反復進行優化和做消虛頻的操作,最終找出無虛頻的結構。這個過程中會遇到同時存在許多虛頻的結構,虛頻大多都會破壞局部對稱性,這種情況消虛頻常用的做法是按照虛頻模式調結構并重新優化,反復如此直到沒有任何虛頻,這在《Gaussian中幾何優化收斂后Freq時出現NO或虛頻的原因和解決方法》(http://www.shanxitv.org/278)中專門說過。取決于以這種方式消虛頻的消除順序,最終得到的無虛頻結構可能不同。前述的三種極小點結構是以不同方式調結構消虛頻得到的。這么搞不排除遺漏某些極小點的可能,但由于做前述的構型搜索過程中并沒有得到其它能量較低構型,因此可以認為至少不存在值得關注的其它能量很低的極小點結構。
前面圖中最右邊的D3h點群的結構是消除了所有破壞環平面的虛頻后的結構,它依然有平面內的虛頻。它的能量明顯也很高。18氮環不僅能量最低結構不是純平面的,純平面結構就連對應的極小點都沒有。
畢竟18氮環是個新穎的體系,為了100%確保ωB97XD優化的結構合理,此文還在常用的B3LYP-D3(BJ)、PBE0-D3(BJ)、M06-2X泛函下,以及可靠且昂貴的CCSD級別下也都做了優化(對比見補充材料),結果和ωB97XD的高度一致,而且T1診斷體現出18氮環的極小點結構的多參考特征不強而沒必要用多參考方法,因此可以認為本文給出的結構是非常可靠的,笛卡爾坐標在補充材料里提供了。
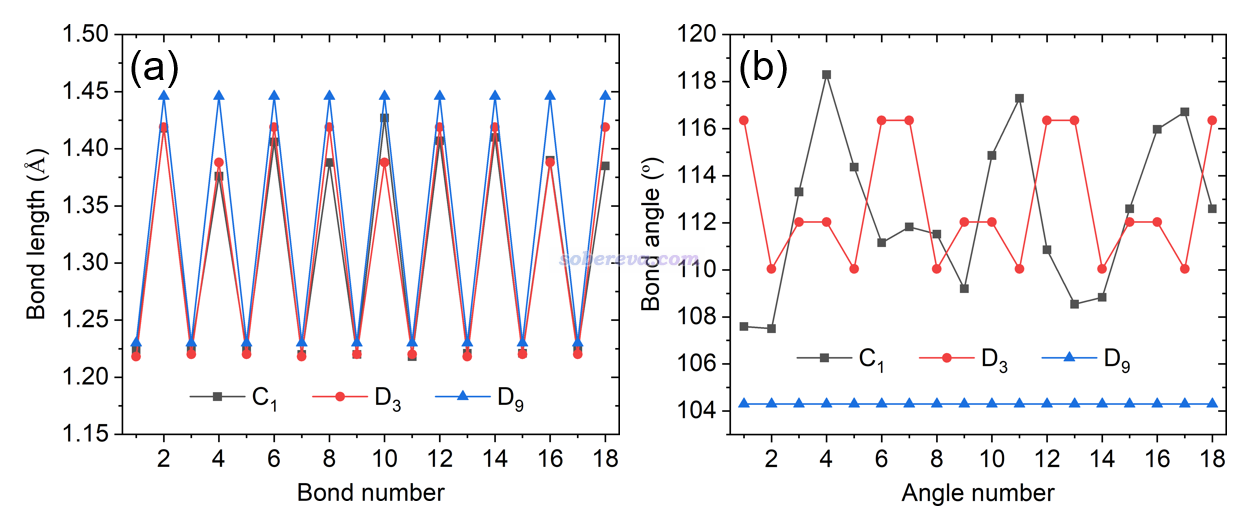
此文利用《使用Multiwfn計算Bond length/order alternation (BLA/BOA)和考察鍵長、鍵級、鍵角、二面角隨鍵序號的變化》(http://www.shanxitv.org/501)介紹的方法,利用Multiwfn很便利地得到了整個環上的鍵長、鍵角的變化圖,如下所示,這從定量層面更進一步展現了18氮環的結構特征。由左圖可見,18氮環上的N-N鍵鍵長是很明顯長-短交替變化的,這也體現出N-N鍵的強弱是顯著交替變化的,這從后文對成鍵本質的分析上可以了解原因。值得一提的是18碳環也具有類似的明顯長-短交替的C-C鍵。D9結構的較長N-N鍵比C1結構中的明顯更長,一定程度體現出D9的穩定性更弱、更易解離。從鍵角變化來看,C1和D3極小點結構的鍵角是在一定范圍內波動的,而高對稱性的D9中所有鍵角等同,而且比所有的C1和D3的鍵角都明顯要小。這過小的鍵角無疑是為了滿足其高對稱性所致,也必定會因此帶來明顯的鍵角張力,這是D9具有很高能量的關鍵原因。
2 18氮環的動力學穩定性
為了研究18氮環的動力學穩定性,以及它的分解機理,此文對C1結構的一個較長的N-N鍵按照《詳談使用Gaussian做勢能面掃描》(http://www.shanxitv.org/474)說的方法進行了逐漸拉長的柔性掃描,發現在掃描路徑上有個極大點,并且根據它和后面一個點的結構可以確認它適合作為搜索解離過程的過渡態的初猜,果然基于它進一步優化過渡態后得到了對應于18氮環解離的過渡態,并由此按照《在Gaussian中計算IRC的方法和常見問題》(http://www.shanxitv.org/400)中的做法進一步跑了IRC,而且要求IRC盡可能跑得完整、理想。下圖是在ωB97XD/def2-TZVP級別下跑的IRC曲線,以及過渡態和IRC最后一幀的結構。過渡態標記為C1-TS,它具有的唯一虛頻對應的振動模式按照《在VMD中繪制Gaussian計算的分子振動矢量的方法》(http://www.shanxitv.org/567)的做法用黃色箭頭繪制了出來。可以看到18氮環的解離不是一次只斷一個N-N鍵,而是三個N-N鍵同時斷開(虛頻模式對應它們仨同時顯著的伸縮運動),直接解離產物是兩個氮氣分子和一個14個氮組成的鏈狀結構。
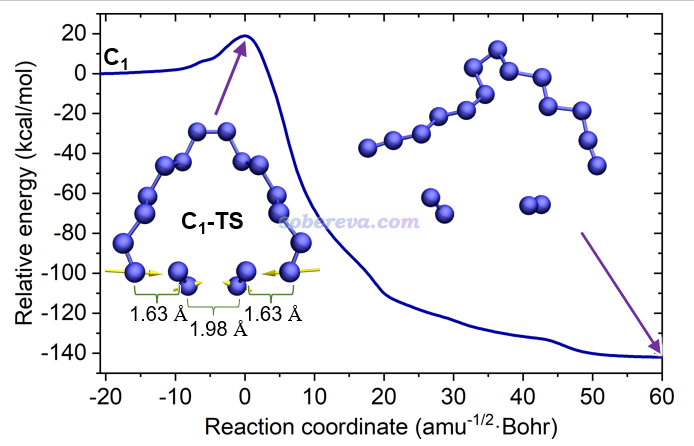
上面的IRC圖左端對應C1結構,以它為能量零點,可見這個反應經歷了18.9 kcal/mol的勢壘。實際上這個勢壘數據并不準確。筆者在高精度的DLPNO-CCSD(T1)/cc-pVQZ級別下對過渡態和C1極小點結構計算了電子能量并求差,得到的高精度勢壘是8.8 kcal/mol,明顯ωB97XD/def2-TZVP嚴重高估了勢壘。再進一步考慮自由能熱校正量后,得到的高精度的標況自由能壘是4.4 kcal/mol。將之代入《基于過渡態理論計算反應速率常數的Excel表格》(http://www.shanxitv.org/310)提供的表格里計算反應速率常數,可知常溫下18氮環解離的反應速率常數是3.7E9 /s,對應于半衰期為180 ps。因此,在常溫下18氮環的壽命極短,轉瞬即解離。然而,在很低溫下它則具有一定穩定性,例如70 K的時候自由能壘為5.5 kcal/mol,對應于半衰期為14.8小時(如果再考慮隧道效應會更短)。所以在極低溫下產生并檢測到18氮環還是有希望的。
3 18氮環的分子動力學行為
前面都是從靜態角度研究18氮環。為了了解其動力學行為,以及從動態角度考察解離過程,此文按照《使用ORCA做從頭算動力學(AIMD)的簡單例子》(http://www.shanxitv.org/576)介紹的做法做了從頭算動力學模擬。如前所述,ωB97XD/def2-TZVP嚴重高估了解離勢壘,勢必會導致在動力學過程中嚴重高估結構的穩定性,因此必須選擇一個又足夠便宜又能較好符合DLPNO-CCSD(T1)/cc-pVQZ高精度計算的勢壘的級別。測試發現B3LYP-D3(BJ)/def2-SVP可以滿足這個要求,因此AIMD在此級別下做。
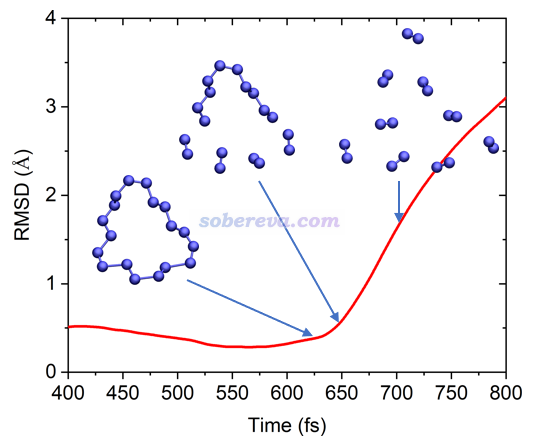
下圖左側是在300K下模擬20 ps過程中18氮環的結構變化,用VMD繪制,每1 ps繪制一次并疊加顯示,根據模擬時間按照藍-白-紅著色以區分。可見在算得動的很有限的模擬時間尺度內,18氮環的骨架結構保持得較好,始終都在C1極小點結構附近波動。
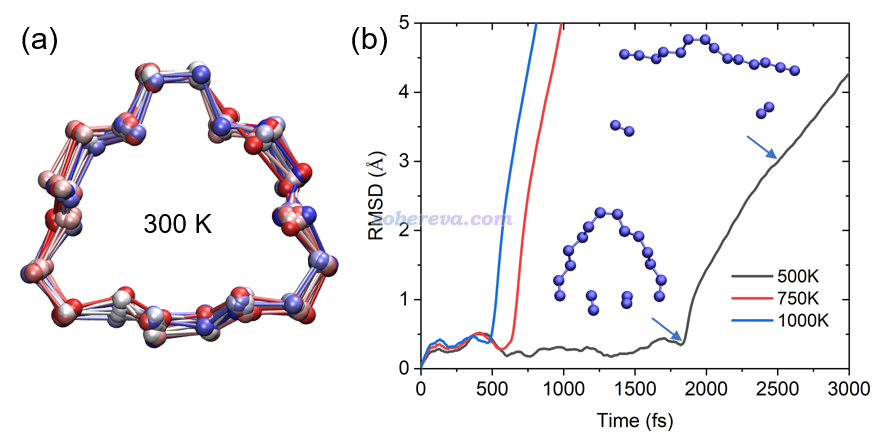
上圖右側是分別在較高的500K、750K、1000K下模擬得到的軌跡相對于初始結構的RMSD曲線圖。可見三個溫度下在前3 ps內都發生了解離,而且溫度越高解離時間越早,解離的時刻對應于RMSD突然飆升的位置。從500K曲線上標注的結構可見,在剛解離時,其結構正好和前面優化出的解離過渡態結構C1-TS高度一致,解離產物也和之前跑的IRC的產物端一致,這體現出研究一個反應可以同時在靜態和動態兩個視角下進行。
溫度不光影響解離發生的快慢,還同時影響解離的直接產物。如下圖所示,在750K下18氮環不是先解離出兩個氮氣分子,而是一下子徹底解離成9個氮氣分子。這充分體現出18氮環完全解離成氮氣在高溫下是一瞬間的事,且不經歷中間體。
4 18氮環的能量相關屬性
此文從能量屬性角度對18氮環的特征做了一系列考察。首先此文在DLPNO-CCSD(T1)/cc-pVQZ//ωB97XD/def2-TZVP級別下用Shermo計算了18氮環的標況下的生成自由能和生成焓,分別為685.1和598.7 kcal/mol,前者很大體現出從氮氣分子直接合成18氮環在熱力學上是極度不利的,后者很正體現出當18氮環分解為氮氣分子時會釋放巨大熱量,因此是極為高能的物質。
值得一提的是18氮環并不是N18最穩定的異構體。有前人研究過N3(N5)3分子,和18氮環一樣化學組成都是N18,而N3(N5)3的電子能量和標準自由能分別比18氮環低62.3和56.2 kcal/mol。盡管如此,這并不意味著18氮環就一定不能在實驗上得到。一方面如前所述,本身18氮環在很低溫下就有一定穩定性,另一方面,利用特殊合成手段,亞穩的環狀物質本來也可能得到。例如20個碳連成環狀的20碳環如今在實驗上已經觀測到了,然而高精度理論計算指出碗狀的C20比環狀的C20的能量低得多。
18氮環可以與氧氣反應發生燃燒變成NO2氣體,此反應計算出的標準反應焓是-426.6 kcal/mol。這體現出若18氮環固體能制備出來,它可以作為可燃材料,而且由于氮氣是空氣中含量最多的分子,它在原理上還可以無限產生。
環張力是環狀分子重要的特征,在《談談如何計算環張力能:以CPP和碳單環體系為例》(http://www.shanxitv.org/698)里有詳細的計算方式的介紹。為了考察18氮環的環張力的大小,此文通過同聯反應法計算了其最穩定的C1結構的環張力能,結果為6.3 kcal/mol。相比之下,18碳環的環張力能61.7 kcal/mol以及含有18個碳的[18]環聚乙炔的環張力能70.0 kcal/mol都遠大于之,這體現出18氮環環張力能極小,也因此環張力并不是18氮環具有很高能量的原因。之所以它的環張力能相對非常小,在于它由于缺乏整體的pi共軛,使得它的骨架柔性較大,可以自發避免顯著形成環張力。
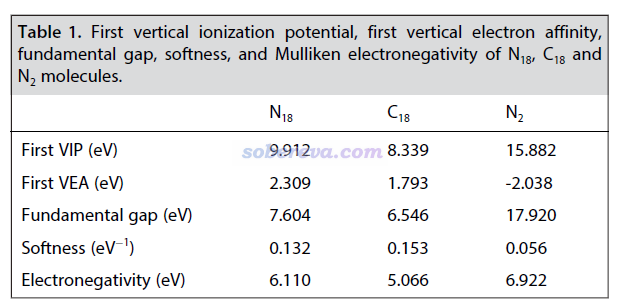
此文還在ωB97XD/aug-cc-pVTZ級別下計算了18氮環的第一垂直電離能、第一垂直電子親和能、fundamental gap(等于電子硬度)、電子軟度和電負性,并與18碳環和氮氣分子做了對比,如下表所示。可見18氮環的電離能比氮氣分子小得多,主要在于18氮環的較長的N-N鍵遠比氮氣分子的N-N鍵弱得多,因此成鍵軌道能量較高,自然其電子更容易電離。氮氣分子的電子親和能為負,說明沒法再結合額外的電子,這在于它的LUMO軌道是反pi特征,被電子占據后自然會由于削弱成鍵作用而令能量變得更高。而18氮環的電子親和能則為正,說明可以再結合電子形成(N18)-陰離子。之所以它還有再額外結合電子的能力,在于它的最低空軌道并不完全對應反pi特征,而是對部分N-N鍵來說還具有成鍵軌道特征,因此被電子占據后還能令體系能量變得更低。18氮環的電子軟度比氮氣分子大很多,說明18氮環的電子整體更容易變形、被極化。與18碳環相比,由VIP和VEA可見18氮環更難失電子而更容易得電子,這也正對應于表中它具有明顯更大的電負性,相對來說是更好的電子受體。
5 18氮環的分子光譜
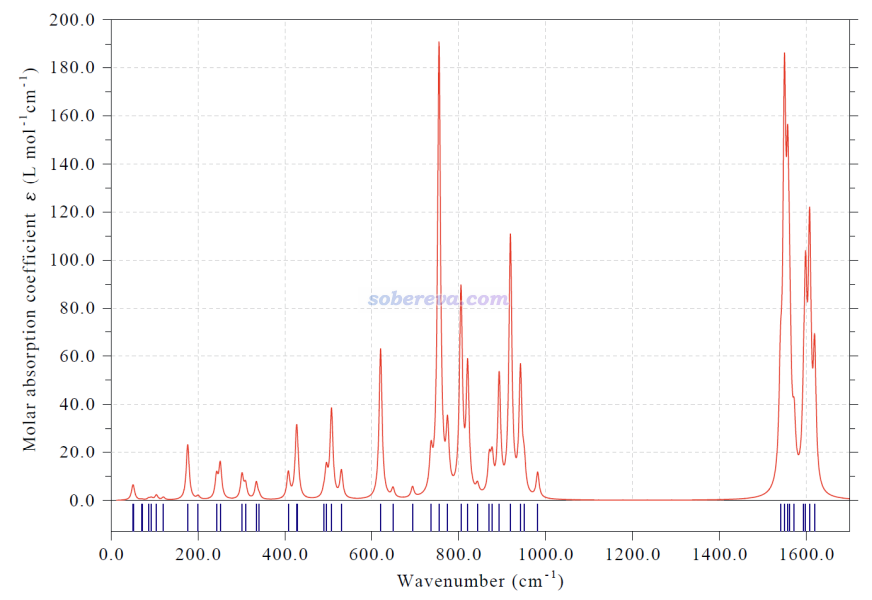
為了令實驗化學家在未來可以通過光譜技術檢測18氮環,本文理論預測了它的振動光譜和電子光譜。按照《使用Multiwfn繪制紅外、拉曼、UV-Vis、ECD、VCD和ROA光譜圖》(http://www.shanxitv.org/224)的做法用Multiwfn模擬的18氮環的基于諧振近似的紅外光譜如下所示。由于C1結構的18氮環不像18碳環那樣具有高對稱性,因此也沒有對稱禁阻現象,使得它的光譜特征比碳環類體系的豐富的多。筆者發表的不同尺寸碳環的振動光譜和振動行為的專題研究介紹見《揭示各種新奇的碳環體系的振動特征》(http://www.shanxitv.org/578),里面給出了18碳環的紅外光譜。相比之下,18氮環不具備18碳環那樣在某些振動模式上具有特別強的紅外吸收強度的特征。同樣在ωB97XD/def2-TZVP級別下做諧振近似的振動分析,18氮環紅外強度最強的振動模式的強度是23.7 km/mol,而18碳環則高達224.4 km/mol。
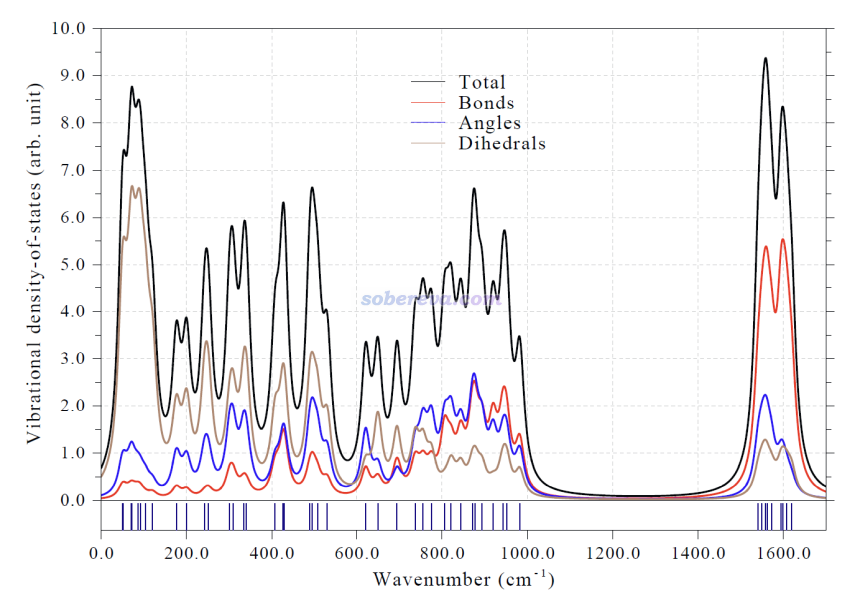
Multiwfn具有繪制分振動態密度圖(partial vibrational density-of-state maps, PVDOS)的功能,由此可以了解不同頻率范圍的振動模式主要對應的是什么區域或什么特征的運動。下圖繪制了總的振動態密度圖,并且鍵伸縮、鍵角彎曲、二面角扭轉三類運動模式的PVDOS也分別給出了。可見在整個波數范圍內,三類運動模式之間都有顯著的耦合,但導致18氮環骨架大幅變化的二面角扭轉模式主要貢獻的是中、低頻部分,而高頻部分更多來自于剛性的鍵伸縮運動模式。
文中還用Multiwfn模擬了18氮環的UV-Vis光譜圖,如下所示,使用的是TDDFT結合PBE0/def2-TZVP。對于不牽扯里德堡激發、電荷轉移激發的單重態價層激發的情況,PBE0通常是較好選擇,沒有明顯高估和低谷激發能的趨勢,這在《亂談激發態的計算方法》(http://www.shanxitv.org/265)里說過。從模擬的譜圖上可見18碳環在可見光區的吸收可忽略不計,因此基本上可認為是無色的,起碼是對于當前研究的孤立狀態來說。PS:想更嚴格預測可以用《通過量子化學計算和Multiwfn程序預測化學物質的顏色》(http://www.shanxitv.org/662》里說的方法。
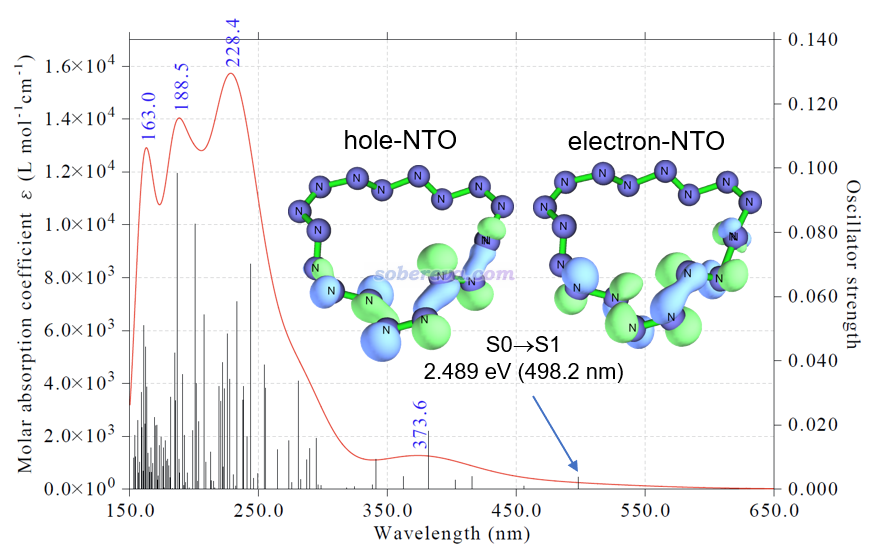
對于18碳環這樣基態是單重態的分子,通常最關鍵的電子激發是S0到S1的激發。為了考察其電子激發本質,文中按照《使用Multiwfn做自然躍遷軌道(NTO)分析》(http://www.shanxitv.org/377)所述的方法用Multiwfn對S0-S1激發做了NTO分析,并發現此電子激發基本可以由上圖中的hole-NTO到electron-NTO的躍遷來描述。從等值面圖可以看出,hole-NTO同時具有孤對電子(n)和sigma軌道的特征,而electron-NTO則只有反pi(pi*)軌道特征,因此S0-S1激發可以認為是n-pi*和sigma-pi*的雜化激發。這種情況對于普通有機體系是極其罕見的,因為其sigma占據軌道能量一般都較低,很難在S0-S1激發中牽扯到。
6 18氮環的電子結構
18氮環具有非同尋常的電子結構,這是本文研究的關鍵重點,必須充分運用波函數分析的手段才能考察。
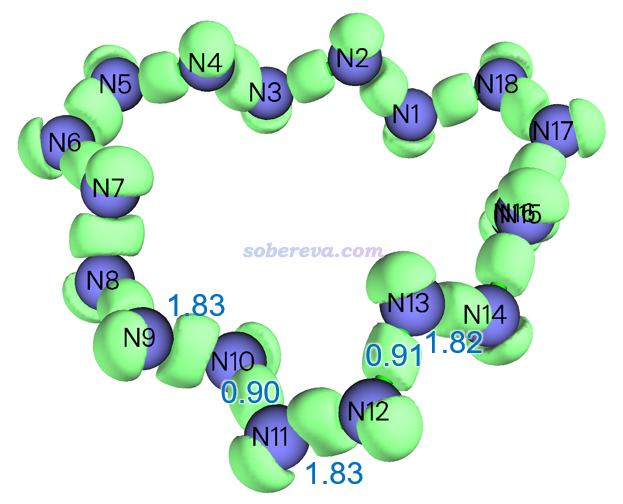
LOL是一個重要的考察定域化電子出現區域的實空間函數,參見《Multiwfn支持的分析化學鍵的方法一覽》(http://www.shanxitv.org/471)里的簡介。文中使用Multiwfn繪制了18氮環的LOL函數的0.55的等值面圖,如下所示,上面標注的數字是Multiwfn算的Mayer鍵級值。由此圖可以明顯看出18氮環有顯著的N-N共價鍵,同時每個氮上還都有顯著的孤對電子。
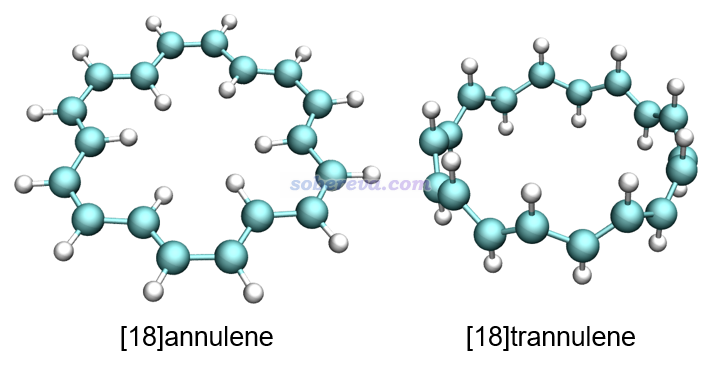
很值得一提的是,前面第1節給出的D3和D9點群的18氮環的幾何結構像極了下圖所示的[18]annulene和[18]trannulene,它們都有長-短鍵交替的特征,關鍵差別在于每個C-H單元在18氮環里對應一個氮原子,也可以視為每個C-H共享的電子對對應于氮原子上的孤對電子。顯然,18氮環中的氮原子的雜化狀態可以視為與[18]annulene和[18]trannulene中的碳原子一樣是sp2雜化。
由于18氮環中的孤對電子之間距離較近,因此孤對電子之間可能存在位阻-互斥效應,文中補充材料中S1節對此進行了專門的分析討論并通過計算證實了這一點。D9結構下孤對電子之間的位阻-互斥效應尤為明顯,這是其結構能量很高的另一個原因。
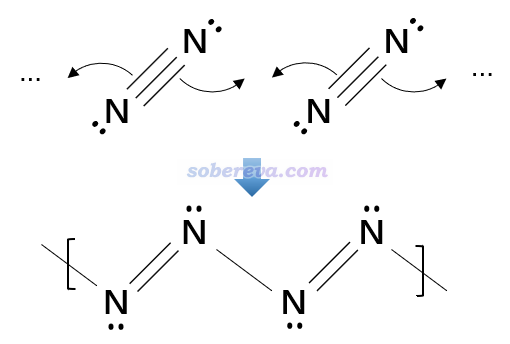
Mayer鍵級反映了原子間等效的共享電子對數。從前面的LOL等值面圖上標注的Mayer鍵級可見,18氮環中N-N鍵近似可以視為具有單-雙鍵交替特征。也由此,可以把18氮環的形成用下圖來示意,即它是由氮氣分子聚合而成的環狀產物,聚合過程中每個氮氣分子的N-N三鍵變成雙鍵,并與每一側的另一個氮氣分子形成一個單鍵。這非常類似于乙炔形成聚乙炔的過程,只不過聚合產生的氮鏈遠沒那么穩定。值得一提的是,氮鏈類物質已經在高壓合成的一些晶體中觀測到了,只不過目前觀測到的物質中氮鏈都是與過渡金屬配位的狀態。
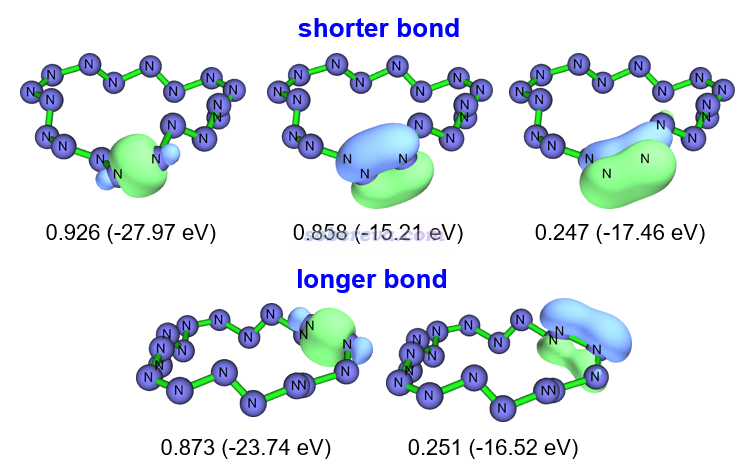
為了能更充分地理解18氮環的成鍵,文中還使用Multiwfn按照《使用鍵級密度(BOD)和自然適應性軌道(NAdO)圖形化研究化學鍵》(http://www.shanxitv.org/535)和《使用Multiwfn對周期性體系做鍵級分析和NAdO分析考察成鍵特征》(http://www.shanxitv.org/719)中介紹的NAdO方法對18氮環的N-N鍵進行了考察。每個化學鍵的模糊鍵級可以分解為一系列NAdO軌道的貢獻,通過觀看NAdO軌道的特征,就可以確切了解鍵級內在對應了什么樣的相互作用。對一個較短和一個較長N-N鍵進行的NAdO分析的結果如下,只有貢獻相對顯著(大于0.2)的NAdO軌道被列了出來,括號外的是NAdO軌道對鍵級的貢獻,括號內的是軌道的能量。可見較短的N-N鍵基本上可以視為一個sigma和一個pi鍵構成,因為相應的兩個NAdO軌道對模糊鍵級的貢獻0.926和0.858都很大且接近1,而其余的NAdO的貢獻遠遠小于它們。對較長N-N鍵的模糊鍵級貢獻接近1的僅僅有一個sigma特征的NAdO軌道。由此可以看到,18氮環中的N-N鍵其實在成鍵特征上并沒有什么特別之處,可以近似視為是較典型的sigma+pi雙鍵與sigma單鍵的交替出現。值得注意的是,如標注的NAdO軌道能量所體現的,較長N-N鍵的sigma軌道的能量是明顯高于較短N-N鍵的,而且前者對鍵級的貢獻更小,這說明較長N-N鍵的sigma軌道相對更弱。
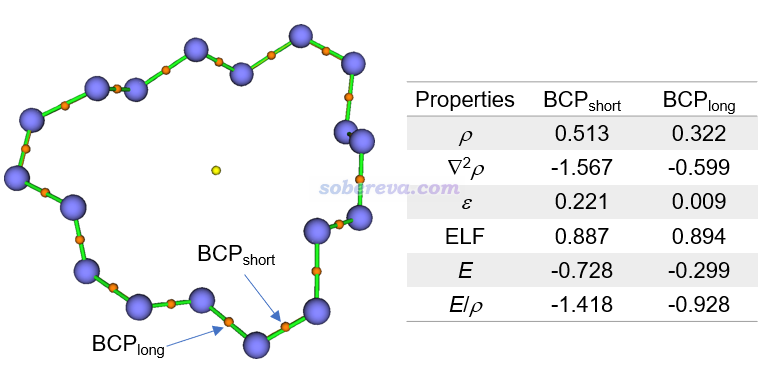
文中還用Multiwfn對18氮環做了AIM拓撲分析,這是討論化學鍵非常常用的方法,見《Multiwfn支持的分析化學鍵的方法一覽》(http://www.shanxitv.org/471)以及《AIM學習資料和重要文獻合集(http://bbs.keinsci.com/thread-362-1-1.html)。下圖左側圖中橙色小圓球是鍵臨界點(BCP),對具有代表性的一個較長和較短的N-N鍵的BCP計算的結果如下圖右側所示。BCP位置的電子密度(ρ)及每電子能量密度(E/ρ)體現出較短的N-N鍵相對更強。電子密度拉的普拉斯函數值▽2ρ和能量密度都為負體現出兩類N-N鍵都屬于典型的共價鍵。BCP位置很大的ELF值體現出成鍵的電子具有很強的定域性,這也是共價鍵的典型特征。較短的N-N鍵的BCP處的電子密度的橢率ε明顯大于0,體現出它具有顯著的單套pi作用特征,而較長的N-N鍵的這個值則基本為0,說明成鍵區域電子密度幾乎完全軸對稱,故基本上是純sigma的作用。這些結論和前述的其它分析相一致。
分子的靜電勢對于討論分子間相互作用有極其重要的意義,相關信息參看《靜電勢與平均局部離子化能相關資料合集》(http://bbs.keinsci.com/thread-219-1-1.html)。基于《使用Multiwfn+VMD快速地繪制靜電勢著色的分子范德華表面圖和分子間穿透圖》(http://www.shanxitv.org/443)和《使用Multiwfn結合VMD分析和繪制分子表面靜電勢分布》(http://www.shanxitv.org/196)中介紹的方法,本文繪制了18氮環范德華表面的靜電勢填色圖并做了表面靜電勢分布的定量統計,如下圖所示。從左圖可見,18氮環表面靜電勢分布很不均勻,既有很正的地方,最高達到30 kcal/mol,也有較負的地方,最負為-12.1 kcal/mol。這體現出取決于具體位置,18氮環既可以表現出明顯的局部Lewis酸性特征,也可以表現出一定Lewis堿性特征(主要來自于孤對電子)。
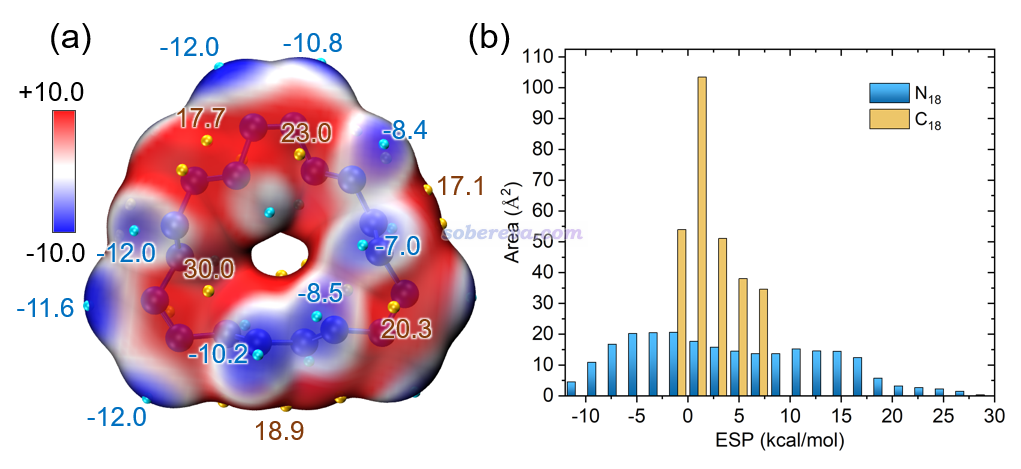
上圖右側的不同靜電勢范圍的面積統計圖中同時包含18氮環和18碳環的情況。通過對比可明顯看出18氮環的靜電勢分布范圍較廣,而18碳環僅分布在數值接近0的較窄的范圍內,這在《全面探究18碳環獨特的分子間相互作用與pi-pi堆積特征》(http://www.shanxitv.org/572)介紹的筆者的研究文章里也專門討論過。這體現出18氮環有形成靜電主導的分子間相互作用的能力,而18碳環則只能形成范德華作用主導的相互作用。筆者曾基于表面靜電勢提出過MPI指數衡量分子的等效極性,詳見《談談如何衡量分子的極性》(http://www.shanxitv.org/518)。18氮環和18碳環的MPI分別為8.0和2.6 kcal/mol,對比可見18氮環的極性顯著大于18碳環。值得一提的是靠偶極矩是無法如實區分它們的極性的,C1結構下的18氮環的偶極矩僅為0.161 Debye,和偶極矩精確為0的中心對稱的18碳環幾乎沒什么區別。
本文還計算了18氮環的原子電荷以考察其電荷分布特征。原子電荷概念的介紹見《一篇深入淺出、完整全面介紹原子電荷的綜述文章已發表!》(http://www.shanxitv.org/714)里提到的筆者的綜述文章。無論是用ADCH原子電荷還是CHELPG原子電荷,得到的18氮環的原子電荷都分布在很窄的范圍內(ADCH電荷在-0.023至0.029之間),因此18氮環里每個原子所帶的凈電荷甚微、感受到的化學環境高度相似。
18碳環具有明顯的芳香性和整體的pi電子的離域性,這在筆者的論文Carbon, 165, 468-475 (2020)中層做過全面、深入的討論。18氮環是否也有這樣的特征?為了揭曉答案,文中首先使用Multiwfn計算了多中心鍵級,這是衡量電子多中心離域強度的非常流行的指標,見《衡量芳香性的方法以及在Multiwfn中的計算》(http://www.shanxitv.org/176)和《使用AdNDP方法以及ELF/LOL、多中心鍵級研究多中心鍵》(http://www.shanxitv.org/138)中的介紹。18氮環的多中心鍵級的計算結果近乎精確為0,也遠遠小于18碳環,因此從這一點上已經證明18氮環不具備像18碳環一樣明顯的整體電子離域特征,因而也沒有芳香性。18氮環盡管有很多pi電子,但這些pi電子完全定域在一個個化學鍵上,并沒有有效聯通為整體。
《通過Multiwfn繪制等化學屏蔽表面(ICSS)研究芳香性》(http://www.shanxitv.org/216)介紹的通過繪制ICSS_ZZ等值面圖考察芳香性的方法雖然昂貴,但是非常嚴格而且直觀,也比流行的NICS更有說服力。為了進一步確認18氮環的芳香性,文中使用Multiwfn繪制了18氮環的ICSS_ZZ等值面圖,如下所示,C1和D9構型的圖都給出了,等值面數值也標出來了。圖中綠色和藍色區域分別是對垂直于環方向上施加的磁場產生屏蔽和去屏蔽的區域。無論哪種構型,其等值面特征都和具有典型芳香性分子的情況截然不同(即環中心區域完全是磁屏蔽,而環外側是一圈連貫的去屏蔽),進一步證明了無論哪種構型,18氮環都不具備芳香性。
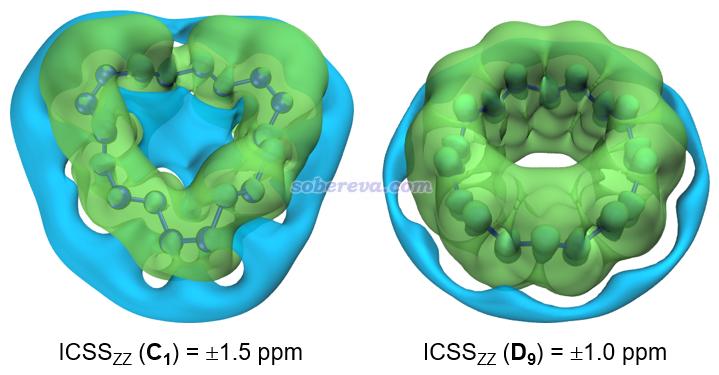
最后,文章還根據《使用AICD 2.0繪制磁感應電流圖》(http://www.shanxitv.org/294)的做法繪制了18氮環兩種構型的感生電流圖。由下圖可見,無論哪種構型都沒形成像Carbon, 165, 468-475 (2020)中的18碳環那樣環繞整體的磁感生電流,再次確認了18氮環的非芳香性特征。

7 總結
本文淺顯易懂地介紹了近期發表的專門研究新穎的18氮環特征的文章ChemPhysChem, 25, e202400377 (2024)的主要內容,更多細節請讀者閱讀原文。此文不僅首次研究了18個氮原子形成的大環分子,也是首次系統性考察孤立狀態下純氮構成的長鏈狀物質的特征,它可以視為是氮氣分子作為單體產生的聚合物。相信本文可以明顯拓寬大多數讀者對純氮物質的認識。本文的很多研究思想和分析方式也可以作為范例,在理論預測和分析其它新穎的化學物質時予以借鑒。同時本文也充分體現出使用Multiwfn程序做波函數分析考察新穎物質的電子結構的重要意義。