根據Boltzmann分布計算分子不同構象所占比例
根據Boltzmann分布計算分子不同構象所占比例
文/Sobereva@北京科音
First release: 2012-Oct-20 Last update: 2020-Apr-13
1 前言
一種分子往往有很多構象,每種構象能量各不相同。在平衡狀態下,各種構象出現的比例也是不同的。在很多文獻里都給出根據Boltzmann分布計算的分子在不同構象下的比例,也經常看到有人問怎么算。實際上計算非常簡單,此文專門說明一下。
首先看一個文獻中的例子。下面這張圖出自筆者的研究文章Struct. Chem. 25, 1521 (2014) DOI:10.1007/s11224-014-0430-6 ,利用Boltzmann分布與相對自由能的關系給出了常溫下致癌物benzo[a]pyrene diol epoxide不同構象的出現比例,對anti和syn兩種構型是分別算的
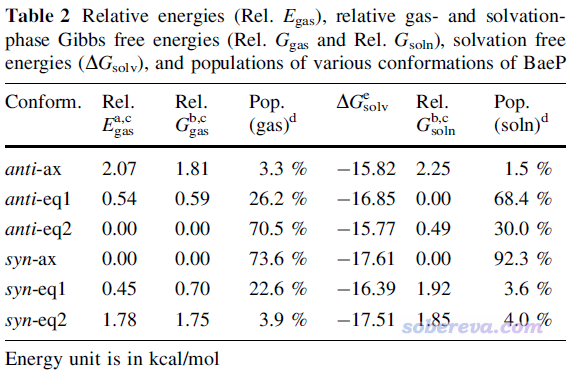
其中氣相下的構象分布比例Pop.(gas)由氣相下的構象間相對自由能Rel. Ggas得到。溶劑環境,尤其是極性溶劑,對構象分布影響往往非常大,千萬不要忽略溶劑效應。上圖中ΔGsolv是在水中的溶解自由能,加到氣相下的相對自由能上就成了溶劑下的相對自由能Rel. Gsoln,由此可以計算出溶劑下的構象分布比例Pop. (soln)。如果你不會算自由能的話,看《談談隱式溶劑模型下溶解自由能和體系自由能的計算》(http://www.shanxitv.org/327)。
Boltzmann分布不僅可以計算不同構象在熱平衡狀態下的出現比例,還可以計算可以互變的不同構型(比如不同結構的分子團簇)的出現比例。
2 構象分布的計算方法
Boltzmann分布的概念在一般的物理化學書上的統計熱力學部分都講過,可以寫為
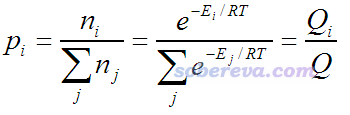
其中p是所占比例,i是構象編號,n_i是處于第i構象的分子數,E是指構象的能量。T是溫度(開爾文),R是理想氣體常數。Q稱作配分函數。
準確計算分子的絕對能量是極其困難的,只有極小的體系,用極高精度量化方法才能得到定量準確的結果。好在Boltzmann公式按如下方式可以等價地寫為只依賴于不同構象間相對能量的形式,相對能量比較容易得到定量準確的結果。
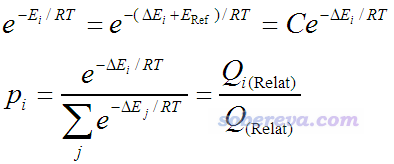
式中E_Ref代表所有構象中能量最低值(參考值),ΔE是相對值,參考值對應的常數項C在計算p的時候同時作為分子分母而消掉了。Q下標上的Relat代表Relative的含義。
根據上面式子,只需利用Excel就可以很容易地計算構象分布比例了。我制作好的Excel表格可以在這里下載:http://www.shanxitv.org/attach/165/Boltzmann.xls,表格截圖如下所示
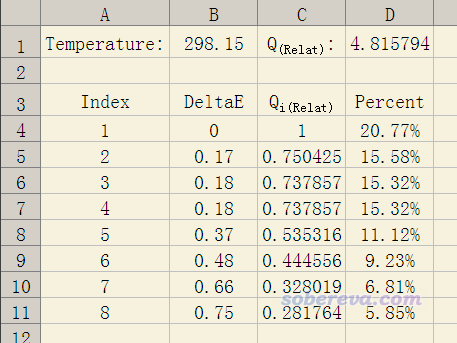
在本文一開始我的論文里的例子里可見,在水環境下三個anti構型的不同構象相對自由能分別是0.00、0.49、2.25 kcal/mol,我們想計算出對應的Boltzmann分布比例,就把Excel表格設成下面的樣子,不需要的單元格直接刪掉即可。可見得到的分布比例和我的論文里給出的完全一樣。

需要說明的是,前面所謂的構象的能量是指自由能。所以,必須先優化到相應構象結構,計算電子能量,再做振動分析,把熱力學校正量加上去得到自由能。在什么溫度下計算分布比例,就應當在什么溫度下計算熱力學校正量。另外,若想根據Boltzmann公式定量精確地計算各個構象的比例必須把自由能算得很準,推薦用熱力學組合方法來算,如G3(MP2)//B3LYP、CBS-QB3等方法,但這些高精度熱力學組合方法很昂貴,哪怕是其中較便宜的方法在很好的機子上跑,用于超過30個原子也基本沒戲。
使用我開發的Shermo程序可以直接基于量子化學程序的輸出文件非常方便地計算出Boltmann分布比例以及構象/構型權重的各種熱力學量,非常推薦大家使用,參見《使用Shermo結合量子化學程序方便地計算分子的各種熱力學數據》(http://www.shanxitv.org/552)。
順帶一提,如果你都不知道一個分子都有什么構象的話,計算構象的Boltzmann分布前需要先做構象搜索。Molclus是我最推薦的構象搜索程序,非常靈活好用還完全免費,詳見http://www.keinsci.com/research/molclus.html。
3 溫度對構象分布的影響
假設體系只有相對自由能為0.00, 0.17, 0.37, 0.66, 0.75 kcal/mol的這五種構象,并且忽略溫度對自由能的影響,我們可以利用Boltzmann分布關系看看從低溫到高溫的過程中它們所占比例是如何變化的,如下所示:
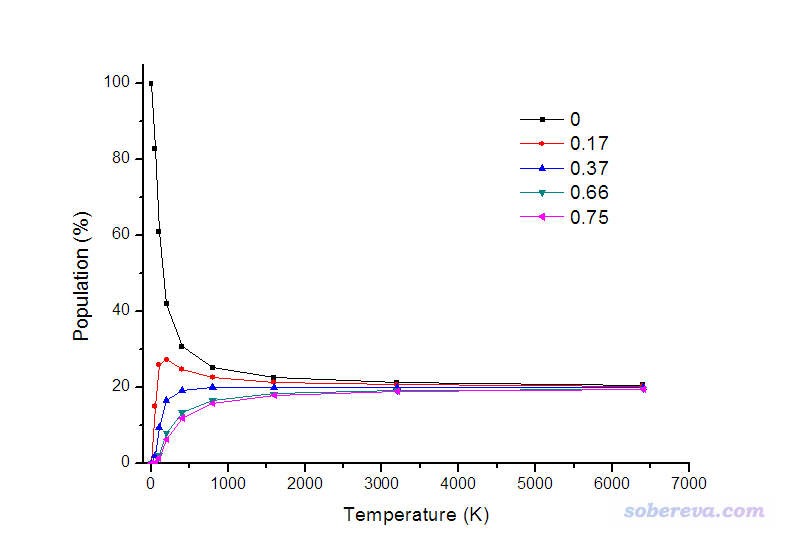
從圖上看,溫度很低時,分子基本都處于能量最低的構象,在0 K時100%處于這種構象。由于幾種構象能量差異并不大,在室溫級別下其它構象所占比例就已經不可忽視了。當溫度無窮高,能量差異已經顯不出來了,各種構象所占比例就相等了。不過實際上這圖并沒有什么物理意義,首先,在計算時忽視了不同溫度下各構象自由能的變化;其次,當溫度較高時,不同構象之間的界限已經很含糊了,較高的動能可以讓分子構象隨意變換而幾乎無視構象間勢壘的存在,因此討論哪個構象占比例多少已經沒有太大意義;而溫度極高時,分子就徹底解離了。