談談如何通過勢壘判斷反應是否容易發生
談談如何通過勢壘判斷反應是否容易發生
文/Sobereva@北京科音 2019-Aug-23
經常有人問“反應勢壘小于多少反應才容易發生?”這種問題,本文就專門說一下。
1 拿什么來衡量反應快慢?
首先要明確“勢壘”或“能壘”(barrier)到底是指什么。這個詞比較含糊,可以指代很多種,比如:
(1)電子能壘:用過渡態結構的電子能量減反應物結構的電子能量。電子能量是指什么這里說了《談談該從Gaussian輸出文件中的什么地方讀電子能量》(http://www.shanxitv.org/488)
(2)焓壘:用過渡態結構的焓減反應物結構的焓。
(3)自由能壘:用過渡態結構的自由能減反應物結構的自由能。
目前最常用,也比較省事的預測反應速率常數k的方法是Eyring的過渡態理論(transition state theory, TST),它可以寫為基于配分函數的形式和基于熱力學量的形式;對于后者,k是由自由能壘直接決定的,相關知識和具體公式看《基于過渡態理論計算反應速率常數的Excel表格》(http://www.shanxitv.org/310),k可以直接用里面的Excel表格計算。因此,用自由能壘討論反應是否容易發生無疑是最嚴格的,自由能怎么算在這里也有明確說明:《使用Shermo結合量子化學程序方便地計算分子的各種熱力學數據》(http://www.shanxitv.org/552)、《談談隱式溶劑模型下溶解自由能和體系自由能的計算》(http://www.shanxitv.org/327)。但是,計算自由能得做振動分析,故需要額外多做一步,而且也需要花不少耗時,因此如果你想在討論時圖省事,用電子能壘討論往往也可以接受,而且電子能量對自由能有主導性(雖然也有很多例外),但這種做法審稿人答不答應那就難說了,很可能屆時會讓你補算自由能再重新討論。顯然,當我們計算自由能的時候,你考察什么溫度下的反應,自由能就應當在什么溫度下計算,而使用0K下的自由能(等價于0K下的內能和焓,也等于電子能量加上ZPE)來討論是沒有什么實際意義的。
還有一個詞叫活化能(activation energy)。大家學物理化學的時候都學過阿侖尼烏斯公式,里面有一個參數就是活化能。一定要搞清楚,活化能不是通過理論化學的方式直接算出來的,而是根據已知的k與溫度的關系(可以根據TST、做實驗等方式得到),通過阿侖尼烏斯公式擬合出來的。你可以用Origin等程序擬合,也可以通過比如此文介紹的程序自動進行擬合:《使用KiSThelP結合Gaussian基于過渡態理論計算反應速率常數》(http://www.shanxitv.org/246)。然而,在很多文章以及日常討論中,經常把活化能和能壘這兩個詞混淆使用,顯然這是不妥的。但當具體說“活化自由能”這個詞的時候,一般就是指自由能壘;說“活化焓”的時候,一般就是指焓壘。有時候還討論“活化熵”,對應于過渡態位置的熵減去反應物的熵。
PS:活化能并非只能通過阿侖尼烏斯公式擬合。利用動力學模擬,對任何動態過程(如擴散)等也可以計算活化能,見J. Phys. Chem. A, 123, 7185 (2019),這里就不多提了。
實際考察的反應往往是復合反應,即包含很多步基元過程。像這種情況,討論反應是否容易發生應當取決速步的自由能壘。判斷決速步的一種方法如下所示。下圖示例的過程中決速步對應I1到T3的過程,因此可以用T3的自由能減去I1的自由能作為自由能壘計算k、討論反應快慢。(注:也有文章如ChemPhysChem, 12, 1413 (2011)主張廢除決速步的概念而建議用決速態的概念,確實這樣更嚴格,但這不屬于本文討論范疇。決速步這個東西無疑對于討論反應問題是很有實用價值的)
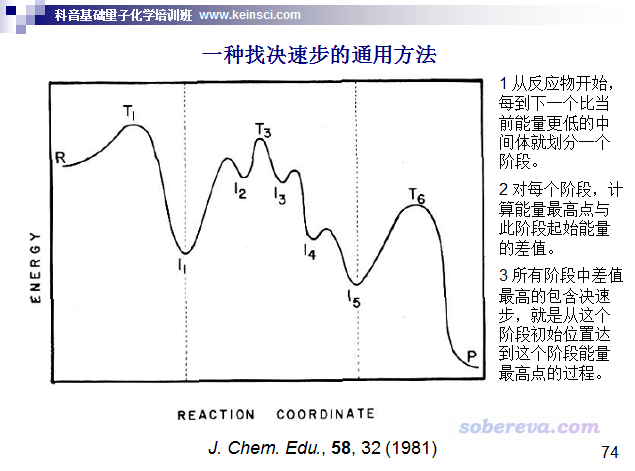
實際上自由能壘不是唯一決定反應快慢的量。對很多反應,特別是低溫、直接涉及到氫的運動的反應,隧道效應是不容忽視的,甚至對k有關鍵性影響。計算隧道效應的方法有一大堆,坑很深,這里就不多說了。隧道效應通過透射系數體現,需要乘到原始的k上,在前述我做的Excel表格里就有通過Wigner和Skodje-Truhlar方法計算透射系數的單元格,一看單元格的注釋就知道怎么用。另外,根據比TST更精確、嚴格的變分過渡態理論(VTST)的思想,計算k用的自由能壘其實并不應當是簡單地拿比如Gaussian里opt=TS關鍵詞直接找的過渡態的自由能與反應物的自由能相減。VTST具體分為很多種,其中最簡單的正則變分過渡態理論(CVT)是用IRC曲線上自由能最大點的自由能與反應物的自由能相減,然后再代入到常規的TST的公式里。
綜上所述,決定反應快慢的是反應速率常數k,只有當隧道效應可忽略不計(即透射系數接近于1.0)、過渡態理論基本適用(即不必非得用VTST的場合),我們才能用過渡態結構的自由能減去與之直接相連的反應物的自由能得到的自由能壘來考察反應是否容易發生反應。下面,我們基于這些假設,討論一下自由能壘低于多少的時候反應算是容易反應。另外別忘了,對于考察多步反應問題,此處說的自由能壘應當取決速步的。
2 單分子反應
首先我們看單分子反應,就是一個分子自身發生的反應,這類最常見的就是分子異構化和分子熱分解。當溫度T以K為單位,自由能壘ΔG≠以kcal/mol為單位,不考慮隧道效應時的TST的計算公式可以明確寫為下面的形式(假定轉動對稱數σ的影響已經體現在了ΔG≠里面了)
![]()
單分子反應的半衰期t(1/2)代表反應物濃度降低為初始濃度一半需要的時間。由于這類具有一階動力學形式的反應滿足[At]=[A0]*exp(-k*t),其中[At]和[A0]分別是t時刻和初始時刻物質的濃度,可知的單分子反應的半衰期為t(1/2)=ln2/k。
比如當T=298.15 K,ΔG≠為30 kcal/mol,代入上式(也可以直接用我的Excel表格算),k為6.2*10^-10 /s,因此半衰期為ln2/(6.2*10^-10)=1117979323秒,折合35年多,時間尺度極大,可見自由能壘為30 kcal/mol時在標況下可以認為不能反應。注意,這里前提是沒有其它物質產生催化效應。例如在土壤上的反應,黏土礦物產生的催化作用可以令一些勢壘超過60 kcal/mol的反應發生。
下面的表格是常溫下反應的ΔG≠不同的時候的情況,里面的k和t(1/2)都可以通過前述公式直接把ΔG≠代進去得到。97% complete相當于是反應基本完畢所花的時間(計算公式為-(ln0.03)/k)。PS:老有人問我這是哪篇文獻的,我也忘了,而且沒有任何必要問出處(也絕對不要問我),因為把自由能壘代入上面提到的式子直接就能得到表格里的數據。
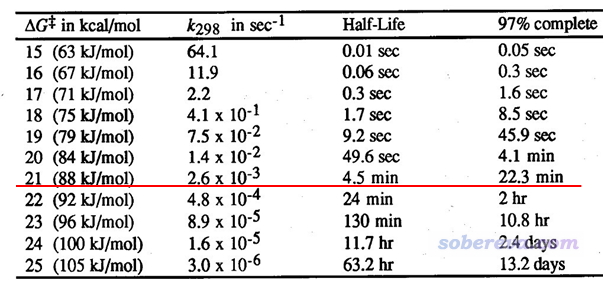
由圖可見,常溫下,自由能壘為21 kcal/mol時只需要4.5分鐘就可以反應完一半,反應比較快。而半衰期對自由能壘相當敏感,哪怕再提升1 kcal/mol,半衰期也會增加到24 min,這就算已經偏慢了。所以,我們通常對單分子反應以自由能壘<=21 kcal/mol作為標準判斷常溫下反應是否容易發生。當然,這個判斷標準適用的前提是這個反應滿足前面提到的各種條件,所以是比較理想化的情況。
上表也體現出自由能計算精度對反應速率常數、半衰期的影響非常大,如果你就用比如B3LYP/6-31G*算自由能壘(包括其中自由能熱校正量和電子能量部分),發現結果是20.1 kcal/mol,于是你就說這個反應容易發生,那顯然是極度不可靠的,因為這種在現在看起來非常low的檔次算自由能壘的誤差經常可以達到幾kcal/mol。這年頭,若計算有機反應自由能壘而且想算得質量不錯,起碼也得用M06-2X/def2-TZVP。
3 雙分子反應
雙分子反應就是A+B兩個分子之間的反應,一般滿足二階動力學特征。根據兩個反應物是相同的還是不同的,有不同的式子,如下所示
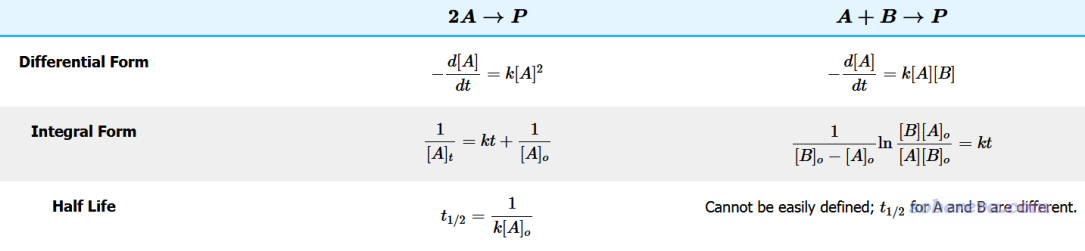
可見,當發生反應的兩個分子相同(兩個分子不同但初始濃度相同也屬于此情況),半衰期公式是t(1/2)=1/(k*[A0]),其中[A0]是反應物初始的濃度,反應速率常數k可以通過雙分子形式的過渡態理論公式來計算,只要把溫度和自由能壘代入前述筆者的Excel表格里就能直接得到。由此可見,由于半衰期不僅依賴于k,我們并沒有簡單辦法說雙分子反應的自由能壘低于多少算是容易反應的。但如果我們假定[A0]=1 M,T=298.15K,將半衰期為5分鐘作為容易反應的標準,那么基于上述筆者計算k的Excel表格并通過Excel的單變量求解功能,可以算出來k大于3.33*10^-3 /(s?M)算是容易反應的,若不考慮隧道效應的話相當于自由能壘應當低于22.7 kcal/mol。另外,從t(1/2)表達式也可以看出,對于滿足“容易反應”的條件,反應物初始濃度越高,自由能壘的上限就越高(但影響有限,畢竟自由能壘變化一丁點,對k的影響就足矣抵消[A0]的影響)。
由上面的表也可以看到,如果發生反應的兩個分子不同,而且初始濃度也不同的話,濃度隨時間的變化公式是比較復雜的,半衰期需要對A分子和B分子分別來定義,而且還必須已知各自的初始濃度,所以這就需要結合具體實驗情況來討論了,這里我就不再多提了。只要初始濃度給定了,那么通過Excel的單變量求解功能,求解出容易發生反應的自由能壘的閾值還是很容易的。
值得注意的是,在計算雙分子反應的自由能壘時(為討論簡便,假設是基元反應),反應物的自由能在計算時應當是用兩個分子孤立狀態下算的自由能加和來得到,而不應當是對反應復合物來計算自由能。因為這樣得到的自由能才適合代入TST公式里得到能與實驗相對應的k。
順帶一提,有的時候有人問,為什么實驗明明容易進行,但從他算出來的勢壘上看,根據以上標準,似乎并不容易進行。導致和實驗對應不上的因素實在太多了,這里隨便舉幾條:(1)計算用的體系的模型和實際不符 (2)該用自由能壘討論卻用了電子能量討論 (3)計算級別太爛或不適合當前體系 (4)溶劑效應沒考慮或考慮不周,諸如有時應當考慮顯式溶劑 (5)計算的反應過程和實際反應機理不同 (6)過渡態理論的假設不滿足,需要考慮隧道效應或者VTST (7) 實際中有其它物質對反應有催化但是計算時沒考慮 (8)計算過程讀錯數據了、數據弄亂了 (9)數據計算流程不合理,有低級錯誤。
附:如果你想系統了解與反應動力學有關的基礎知識、上面提到的半衰期的推導細節,可以參考以下頁面
半衰期:https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Half-lives_and_Pharmacokinetics
零階反應:https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Zero-Order_Reactions
一階反應:https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/First-Order_Reactions
二階反應:https://chem.libretexts.org/Bookshelves/Physical_and_Theoretical_Chemistry_Textbook_Maps/Supplemental_Modules_(Physical_and_Theoretical_Chemistry)/Kinetics/Reaction_Rates/Second-Order_Reactions